Урок 58. Положение галогенов в Периодической системе, строение атомов галогенов. Хлор. Физические и химические свойства хлора. Применение - cтраницы 140, 141, 142, 143
1. Изучите §46. Представьте текст параграфа в виде таблицы:
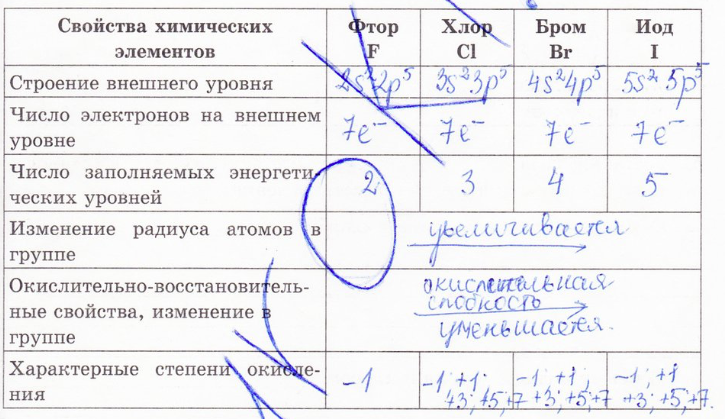

2. В чем различия в строении атомов галогенов?
Атомы галогенов обладают большим зарядом ядра, меньшим атомным радиусом и имеют по одному неспраренному электрону по сравнению с атомами металлов того же периода.
Атомы галогенов обладают большим зарядом ядра, меньшим атомным радиусом и имеют по одному неспраренному электрону по сравнению с атомами металлов того же периода.
3. Почему галогены образуют двухатомные молекулы?
Потому что они содержат один неспаренный электрон, который энергично присоединяет недостающий электрон с другого атома, образуя двухатомную молекулу.
Потому что они содержат один неспаренный электрон, который энергично присоединяет недостающий электрон с другого атома, образуя двухатомную молекулу.
4. Прочитайте §46-47 и заполните таблицу.


5. Составьте уравнения реакций, укажите окислитель и восстановитель, процессы оксиления и восстановления:
а) между бромидом натрия и хлором

б) между иодидом калия и хлором

в) между водородом и хлором

г) между магнием и хлором

д) между калием и иодом

е) между железом и хлором

а) между бромидом натрия и хлором

б) между иодидом калия и хлором

в) между водородом и хлором

г) между магнием и хлором

д) между калием и иодом

е) между железом и хлором

6. Задачи:
1. Вычислите объем водорода, вступившего в реакцию с 15 л хлора.
H2+Cl2->2HCl
vH2=vCl2= 15 л
2. Вычислите объем хлора, оставшегося после реакции между водородом (10 л) и с хлором (15 л).
Cl2+H2->2HCl
vH2=VCl2=10 л
vCl2 остав.=15-10= 5 л
3. Вычислите объем углекислого газа, образующегося при горении в кислороде ацетилена С2Н2 объемом 100 л.
2С2Н2+5О2=2СО2+2Н2О
vСО2=2*vС2Н2=2*100= 200 л.
4. По уравнению химической реакции вычислите объем кислорода необходимого для окисления 25 л (н.у.) оксида углерода (2) до оксида углерода (4).
2СО+О2=2СО2
vО2=1/2 vСО=1/2*25= 12,5 л.
1. Вычислите объем водорода, вступившего в реакцию с 15 л хлора.
H2+Cl2->2HCl
vH2=vCl2= 15 л
2. Вычислите объем хлора, оставшегося после реакции между водородом (10 л) и с хлором (15 л).
Cl2+H2->2HCl
vH2=VCl2=10 л
vCl2 остав.=15-10= 5 л
3. Вычислите объем углекислого газа, образующегося при горении в кислороде ацетилена С2Н2 объемом 100 л.
2С2Н2+5О2=2СО2+2Н2О
vСО2=2*vС2Н2=2*100= 200 л.
4. По уравнению химической реакции вычислите объем кислорода необходимого для окисления 25 л (н.у.) оксида углерода (2) до оксида углерода (4).
2СО+О2=2СО2
vО2=1/2 vСО=1/2*25= 12,5 л.
Уроки 56-57. Обобщение и повторение по темам "Периодический закон" и "Строение вещества" - стр. 136-139Уроки 59-60. Хлороводород. Получение. Физические свойства. Соляная кислота и ее соли - стр. 144-145
Сохраните или поделитесь с одноклассниками:

