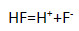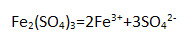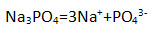Тема 35. Основные положения теории электролитической диссоциации (ТЭД). - cтраницы 167, 168, 169, 170, 171, 172, 173
Признаки электролитов:
- состоят из ионов;
- растворяются в воде.
2. Диссоциация – это процесс распада электролита на ионы.
1. При испытании веществ на электропроводность лампочка загорится, если погрузить электроды:
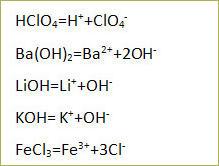
2) в водный раствор гидроксида калия
Напишите уравнение реакции диссоциации электролита.
КОН = К+ + ОН-
2. Наиболее сильным электролитом является:
1) фтороводородная кислота
Напишите уравнение реакции диссоциации наиболее сильного электролита.
3. К слабым электролитам относится каждое из веществ:
2) сероводородная кислота и гидрат аммиака
Напишите уравнения реакции диссоциации наиболее сильных электролитов.
4. Степень электролитической диссоциации уксусной кислоты в растворе уменьшится:
4) при добавлении щёлочи
5. Наибольшее (суммарное) число ионов образуется при диссоциации 1 моль:
3) сульфата железа (III)
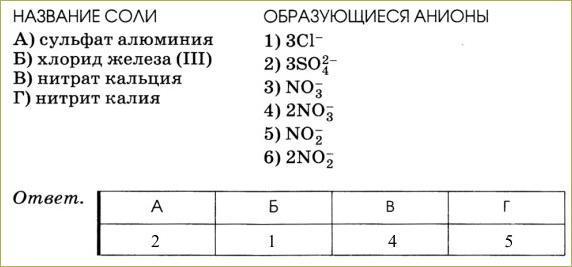
Напишите уравнения электролитической диссоциации.
6. Наибольшее число ионов натрия образуется при диссоциации 1 моль:
4) фосфата натрия
Напишите уравнения электролитической диссоциации.
Сохраните или поделитесь с одноклассниками: