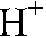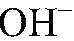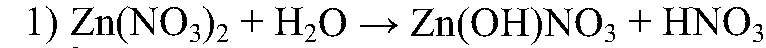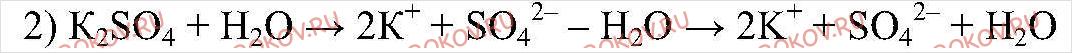Гидролиз солей - cтраницы 38, 39, 40, 41
1. Какие соли подвергаются гидролизу и почему? Объясните это на примерах нитрата цинка, сульфата калия и сульфида натрия.
Гидролизу подвергаются соли, образованные: а) слабым основание и сильной кислотой, б) сильным основанием и слабой кислотой. Это происходит от того, что в составе таких солей имеются ионы, которые могут связываться с ионами
или
(на которые незначительно диссоциирует вода). Например:
(кислая среда)
Соль образована сильной кислотой и слабым основанием.
Соль, образованная сильной кислотой и сильным основанием гидролизу не подвергается.
(щелочная среда)
Если соль образована сильным основанием и слабой кислотой, тогда гидролиз идет с образованием щелочной среды. 4) Соли, образованные слабой кислотой и слабым основанием подвергаются наиболее полному гидролизу. В этом случае реакция среды зависит от степени диссоциации продуктов гидролиза.
2. Напишите уравнения гидролиза солей: карбоната калия, хлорида меди (II) , нитрата свинца (II), фосфата натрия
1. Карбонат Калия.
K2CO3 + HOH ⇄ KHCO3 + KOH
2K+ + CO32- + HOH ⇄ K+ + HCO3- + K+ + OH-
CO32- + HOH ⇄ HCO3- + OH-
раствор имеет щелочную среду.
2. Хлорид меди.
CuCl2 + HOH ⇄ CuOHCl + HCl
Cu2+ + 2Cl- + HOH ⇄ CuOH+ + Cl- + H+ + Cl-
Cu2+ + HOH ⇄ CuOH+ + H+
раствор будет иметь кислую среду.
3. Нитрат Свинца.
Pb(NO3)2 + HOH ⇄ PbOHNO3 + HNO3
Pb2+ + 2NO3- + HOH ⇄ PbOH+ + NO3- + H+ + NO3-
Pb2+ + HOH ⇄ PbOH+ + H+
раствор будет иметь кислую среду.
4. Фосфат натрия(ортофосфат)
Первая
Na3PO4 + HOH ⇄ Na2HPO4 + NaOH
3Na+ + PO43- + HOH ⇄ 2Na+ + HPO42- + Na+ + OH-
PO43- + HOH ⇄ HPO42- + OH-
раствор имеет щелочную среду.
3. Техническую соду, массовая доля примесей в которой составляет 10 %, обработали соляной кислотой. При этом выделилось 4 моль оксида углерода(IV). Вычислите массу технической соды, вступившей в реакцию с кислотой.
Решение
Х моль 4 моль
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
1 моль 1 моль
4 x (2*23 + 12 + 48) = 424 г карбоната натрия вступило в реакцию. это 90%,
а Х - 100%
Х = 424*100 / 90 = 471,1 г
Ответ: 471,1 г.
1. 2)
2. 1)
Сохраните или поделитесь с одноклассниками: